Resumen
Clínica Veterinaria: abordaje diagnóstico y terapéutico
ISSN: 2395-8766
Cómo citar este artículo:
- Ruiz Jiménez F, Martínez Chavarría L, Hernández Castro R, Sánchez Godoy F. Endocarditis valvular vegetativa por Erysipelothrix rhusiopathiae en aves de traspatio. Clínica Veterinaria: abordaje diagnóstico y terapéutico. 2018;4(1).
Descripción del caso: infección sistémica y crónica por Erysipelothrix rhusiopathiae en un gallo de traspatio (Gallus gallus) de dos años de edad.
Hallazgos clínicos: el ave presentaba problemas respiratorios y se encontraba desnutrida. Los hallazgos en la necropsia fueron aerosaculitis crónica, endocarditis valvular vegetativa crónica, degeneración mucoide de la grasa pericárdica y hepatitis necrótica grave zonalmente extensiva y aguda.
Tratamiento y evolución: se le administró Amikacina (Parmikacina®, Laboratorios Parfarm) intramuscular (IM) por 7 días sin mostrar mejoría y murió al día siguiente.
Pruebas de laboratorio: en el examen histopatológico se observó abundante cantidad de colonias bacterianas Gram positivas con morfología de bastón en el endocardio valvular y en la luz de los vasos sanguíneos del pulmón, bazo, hígado y riñón. De igual manera, en el pulmón había un granuloma con hifas intralesionales de Aspergillus sp. El diagnóstico etiológico de Erysipelothrix rhusiopathiae se confirmó por PCR.
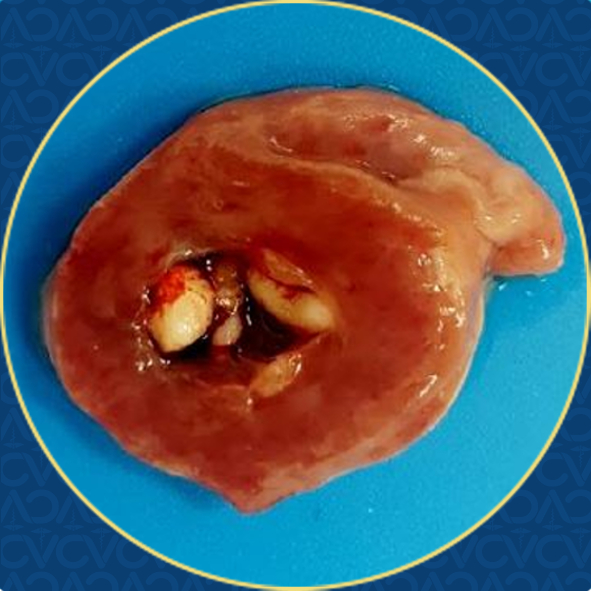
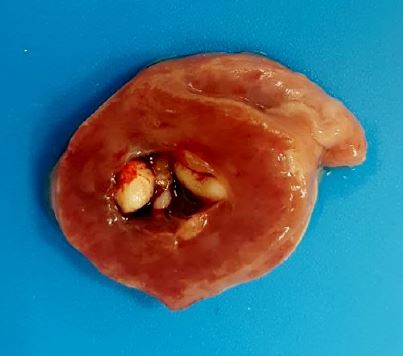
Relevancia clínica: la erisipela se considera un diagnóstico diferencial de infecciones bacterianas sistémicas crónicas en aves no confinadas. La endocarditis valvular vegetativa es una lesión compatible con erisipelosis,
sin embargo, se debe correlacionar con técnicas diagnósticas como el aislamiento bacteriano o la PCR, a fin de establecer un diagnóstico etiológico oportuno, que permita instaurar un tratamiento efectivo en las
aves afectadas.
Figura 2. Endocarditis valvular vegetativa. Válvula atrioventricular izquierda con nódulos firmes de color blanco en su superficie.
Erysipelothrix rhusiopathiae vegetative endocarditis in a backyard flock
Abstract
Case report: Systemic and chronic infection caused by Erysipelothrix rhusiopathiae in a two-year-old backyard rooster (Gallus gallus).
Clinical findings: The bird showed respiratory signs and was emaciated. The gross findings were chronic airsacculitis, chronic valvular vegetative endocarditis, pericardium fatty degeneration and zonal severe acute necrotic hepatitis.
Treatment and evolution: Amikacin (Parmikacina®, Laboratorios Parfarm) was administered to the rooster by the intramuscular route for seven days without showing improvement and he died the next day.
Laboratory tests: The histopathologic examination revealed a copious number of Gram-positive bacilli within the valvular endocardium and in the blood vessels lumen of the lungs, spleen, liver, and kidneys. Additionally, a granuloma intermingled with Aspergillus sp. hyphae was observed in the lung. The etiological diagnosis of Erysipelothrix rhusiopathiae was confirmed with a PCR test.
Clinical relevance: Erysipelas is considered a differential diagnosis of systemic bacterial chronic infections in non-confined birds. Valvular vegetative endocarditis is an erysipelas consistent lesion; however, it must be correlated with other diagnostic tests like bacterial isolation or PCR to determine a precise diagnosis and treat the affected birds effectively.
Referencias
Zhu W, wu C, Kang C, Cai C, Jin M. Development of a duplex PCR for rapid detection and differentiation of Erysipelothrix rhusiopathiae vaccine strains and wild type strains. Vet Microbiol. Elsevier B.V.; 2017;199:108–10. DOI: 10.1016/j.vetmic.2016.11.016
Shimoji Y, Mori Y, Hyakutake K, Sekizaki T, Yokomizo Y. Use of an enrichment broth cultivation-PCR combination assay for rapid diagnosis of swine erysipelas. J Clin Microbiol. 1998;36(1):86–9.
Wang Q, Chang BJ, Riley T V. Erysipelothrix rhusiopathiae. Vet Microbiol. 2010;140(3–4):405–17. DOI: 10.1016/j.vetmic.2009.08.012
Fossum O, Jansson DS, Etterlin PE, Vågsholm I. Causes of mortality in laying hens in different housing systems in 2001 to 2004. Acta Vet Scand. 2009 Jan;51(1):3. DOI: 10.1186/1751-0147-51-3
Eriksson H, Nyman A-K, Fellström C, Wallgren P. Erysipelas in laying hens is associated with housing system. Vet Rec. 2013 Jul;173(1):18. DOI: 10.1136/vr.101388
Crespo R, Garner MM, Hopkins SG, Shah DH. Outbreak of Listeria monocytogenes in an urban poultry flock. BMC Vet Res. 2013 Oct;9(1):204. DOI: 10.1186/1746-6148-9-204
Staats JJ, Feder I, Okwumabua O, Chengappa MM. Streptococcus suis: Past and present. Vet Res Commun. 1997;21(6):381–407.
Devriese LA, Haesebrouck F, Herdt P de, Dom P, Ducatelle R, Desmidt M, et al. Streptococcus suis infections in birds. Avian Pathol. 1994 Dec;23(4):721–4. DOI: 10.1080/03079459408419040
Makino SI, Okada Y, Maruyama T, Ishikawa K, Takahashi T, Nakamura M, et al. Direct and rapid detection of Erysipelothrix rhusiopathiae DNA in animals by PCR. J Clin Microbiol. 1994;32(6):1526–31.
Bobrek K, Gaweł A, Mazurkiewicz M. Infections with Erysipelothrix rhusiopathiae in poultry flocks. Worlds Poult Sci J. 2013;69(4):803–12. DOI: 10.1017/S0043933913000822
Ozawa M, Yamamoto K, Kojima A, Takagi M, Takahashi T. Etiological and biological characteristics of Erysipelothrix rhusiopathiae isolated between 1994 and 2001 from pigs with swine erysipelas in Japan. J Vet Med Sci. 2009;71(6):697–702.
Eriksson H, Brännström S, Skarin H, Chirico J. Characterization of Erysipelothrix rhusiopathiae isolates from laying hens and poultry red mites (Dermanyssus gallinae) from an outbreak of erysipelas. Avian Pathol. 2010;39(6):505–9. DOI: 10.1080/03079457.2010.518313
Mazaheri A, Lierz M, Hafez HM. Investigations on the Pathogenicity of Erysipelothrix rhusiopathiae in Laying Hens. Avian Dis. 2005 Dec;49(4):574–6. DOI: 10.1637/7362-040805R.1
Eriksson H, Bagge E, Båverud V, Fellström C, Jansson DS. Erysipelothrix rhusiopathiae contamination in the poultry house environment during erysipelas outbreaks in organic laying hen flocks. Avian Pathol. Taylor & Francis; 2014;43(3):231–7. DOI: 10.1080/03079457.2014.907485
Eriksson H, Jansson DS, Johansson KE, Båverud V, Chirico J, Aspán A. Characterization of Erysipelothrix rhusiopathiae isolates from poultry, pigs, emus, the poultry red mite and other animals. Vet Microbiol. 2009;137(1–2):98–104. DOI: 10.1016/j.vetmic.2008.12.016
Chirico J, Eriksson H, Fossum O, Jansson D. The poultry red mite, Dermanyssus gallinae, a potential vector of Erysipelothrix rhusiopathiae causing erysipelas in hens. Med Vet Entomol. 2003;17(2):232–4.