 Reto Diagnóstico:
Reto Diagnóstico:
Medicina Interna en un Perro Adulto
Joaquín Aguilar Bobadilla1*
José David Estrada Miranda2
1 Departamento de Medicina, Cirugía y Zootecnia para Pequeñas Especies
Facultad de Medicina Veterinaria y Zootecnia
Universidad Nacional Autónoma de México
Avenida Universidad 3000, 04510,
DF, México
2 Alumno de Maestría en Medicina Veterinaria y Zootecnia,
Endocrinología en Perros,
Facultad de Medicina Veterinaria y Zootecnia
Universidad Nacional Autónoma de México
Avenida Universidad 3000, 04510,
DF, México
*Autor para correspondencia:
Tel: + 52 5556225864
Correo electrónico: jagilarb@hotmail.com
Recibido: 2015-04-23
Aceptado: 2015-06-19
Publicado: 2015-08-31
Información y declaraciones adicionales aquí
Derechos de autor: Joaquín Aguilar Bobadilla et al. 2015
 Distribuido bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0)
Distribuido bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0)
Historia clínica
En el Hospital Veterinario de Especialidades de la Universidad Nacional Autónoma de México (HVE-UNAM) fue evaluada una perra mestiza, de 9 años de edad, 4.5 kg de peso y ovariohisterectomizada. Tres semanas antes de su visita al HVE-UNAM, los propietarios notaron que presentaba hiporexia, debilidad y defecaba pastoso. Había sido atendida previamente por dos médicos veterinarios; el primero le dio tratamiento con metronidazol y ranitidina; el segundo la hospitalizó, le administró terapia de líquidos (se desconoce el tipo de solución que se utilizó) y la medicó con buscapina y omeprazol, sin que se observara mejoría en ninguno de los casos.
Del examen físico realizado en el HVE-UNAM, las únicas anormalidades que presentó fueron 6% de deshidratación, mucosas hiperémicas, condición corporal 2/5, gingivitis, sarro dental y halitosis. Se colectaron muestras de sangre para realizar hemograma y química sanguínea y muestra de orina por micción para urianálisis, obteniéndose los siguientes resultados (cuadros 1, 2 y 3):
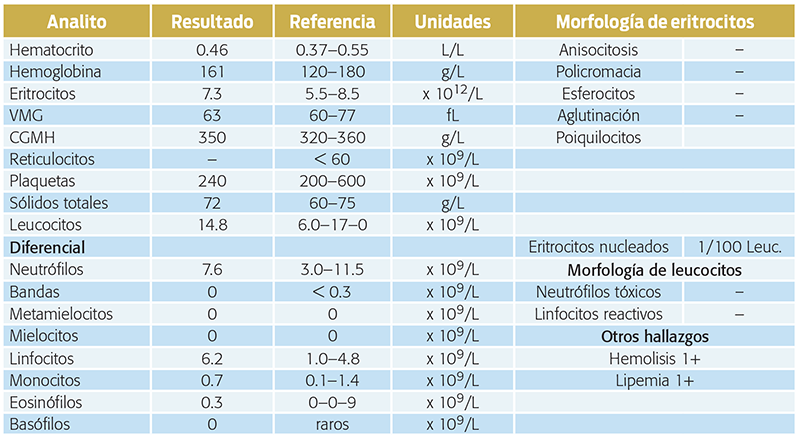
Cuadro 1. Resultados del hemograma realizado en la evaluación inicial de la paciente.
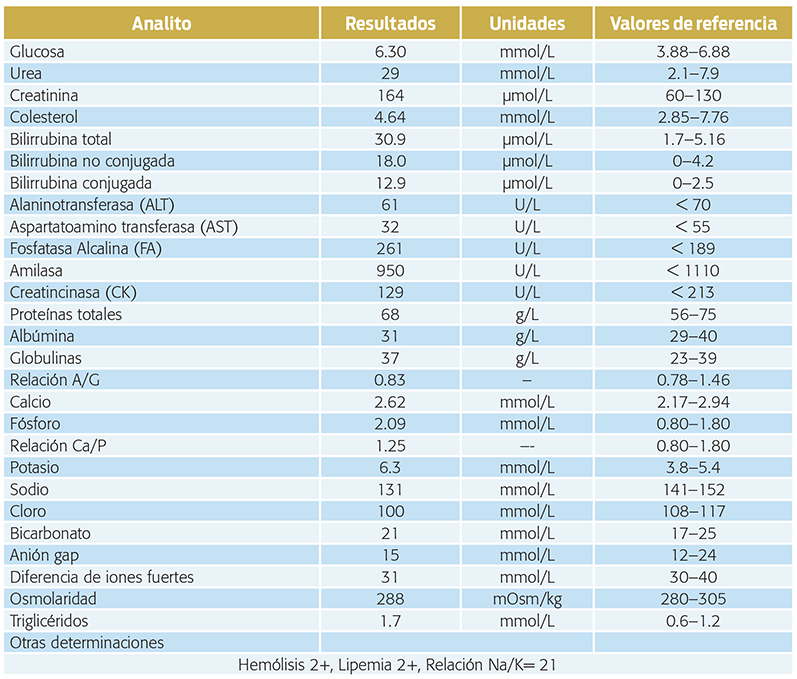
Cuadro 2. Resultados de la bioquímica sanguínea realizada en la evaluación inicial de la paciente.
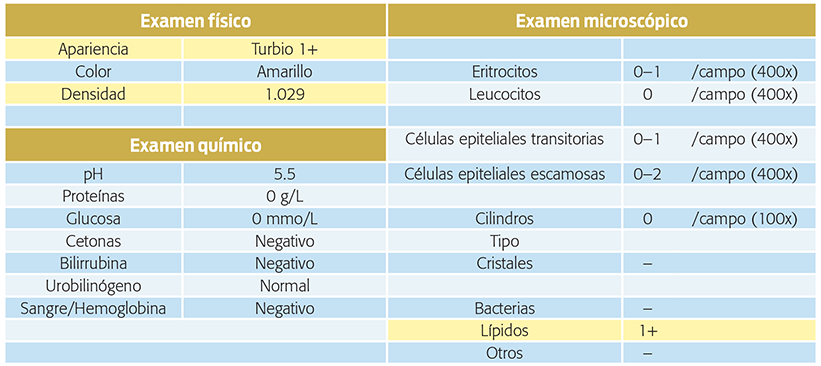
Cuadro 3.Resultados del urianálisis realizado en la evaluación inicial de la paciente, a partir de una muestra obtenida por micción.

Preguntas
1. ¿Qué analitos se encuentran fuera de los rangos de referencia?
2. ¿Cuál es el diagnóstico presuntivo?
3. ¿Cuáles son los hallazgos clave para orientar el diagnóstico?
4. ¿Qué prueba diagnóstica se recomienda para confirmar el diagnóstico?
5. ¿Cuál es el tratamiento y seguimiento para esta enfermedad?
6. ¿Cuál es el pronóstico y evolución esperados en la paciente?
 1. ¿Qué analitos se encuentran fuera de los rangos de referencia?
1. ¿Qué analitos se encuentran fuera de los rangos de referencia?
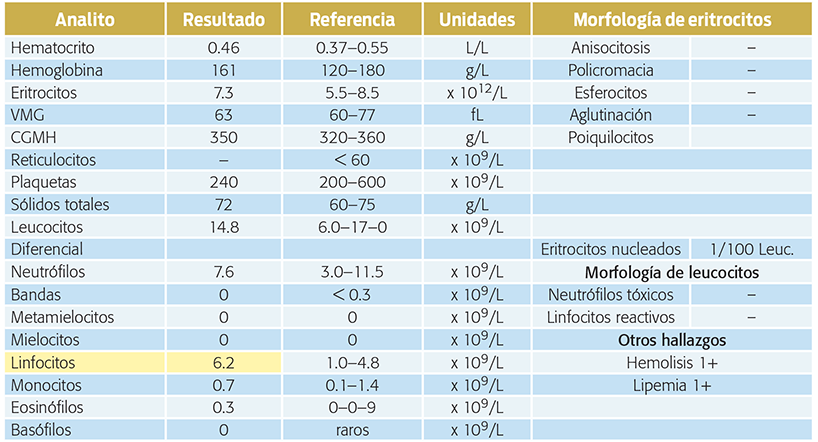
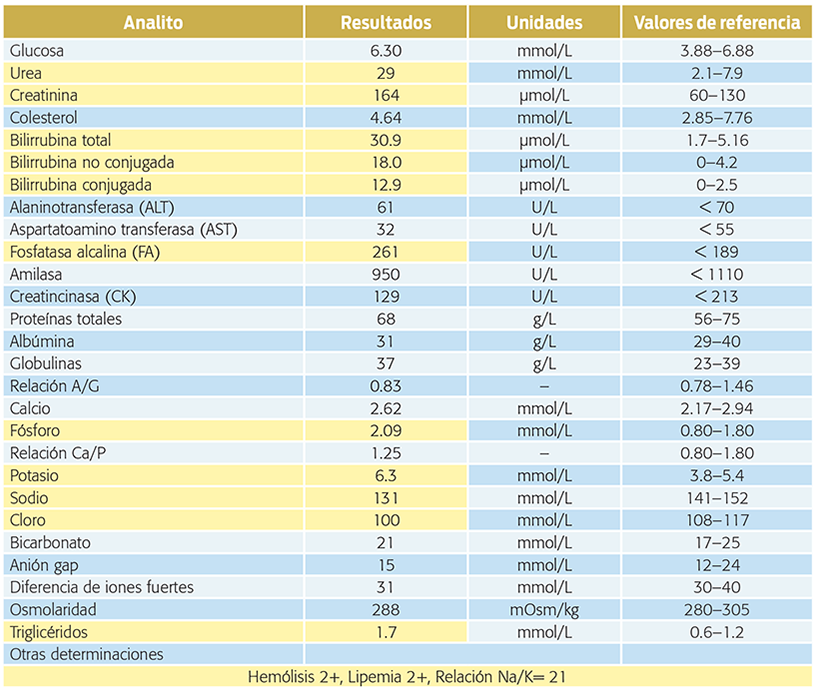
En los siguientes cuadros (4, 5 y 6) están marcados en color amarillo los analitos en los que se encontraron valores por fuera de los rangos de referencia.
Cuadro 4. Resultados del hemograma realizado en la evaluación inicial de la paciente. En amarillo se señalan los analitos que se encuentran fuera de los rangos de referencia.
Cuadro 5. Resultados de la bioquímica sanguínea realizada en la evaluación inicial de la paciente. En amarillo se señalan los analitos que se encuentran fuera de los rangos de referencia.
Cuadro 6. Resultados del urianálisis realizado en la evaluación inicial de la paciente, a partir de una muestra obtenida por micción. En amarillo se señalan los analitos que se encuentran fuera de los rangos de referencia.
 2. ¿Cuál es el diagnóstico presuntivo?
2. ¿Cuál es el diagnóstico presuntivo?
Los hallazgos sugieren hipoadrenocorticismo o enfermedad de Addison.
 3. ¿Cuáles son los hallazgos clave para orientar el diagnóstico?
3. ¿Cuáles son los hallazgos clave para orientar el diagnóstico?
Los hallazgos clave en el hemograma son:
• Linfocitosis.
• Hipercalemia 6.3 mmol/L (3.8–5.4 mmol/L).
• Hiponatremia 131 mmol/L (141–152 mmol/L).
• Hipocloremia 100 mmol/L (108–117 mmol/L).
• Relación sodio/potasio 21.
• Hiperazotemia, urea 29 mmol/L (2.1–7.9 mmol/L).
• Creatinina 164 µmol/L (60–130 mmol/L).
• Densidad urinaria 1.029
El hipoadrenocorticismo o enfermedad de Addison es resultado de la secreción deficiente de mineralocorticoides (aldosterona) y glucocorticoides. El hipoadrenocorticismo primario es el más común, generalmente lo ocasiona la destrucción inmunitaria de la corteza adrenal en gatos y perros. Sin embargo, se ha encontrado que la infiltración linfomatosa de las glándulas adrenales es una causa de hipoadrenocorticismo en los gatos (Feldman, Nelson, 2004).
El hipoadrenocorticismo secundario se origina: a) porque la hipófisis produce cantidades insuficientes de la hormona adrenocorticotrópica (acth) –este tipo de hipoadrenocorticismo es raro tanto en perros como en gatos–, b), por el retiro abrupto de glucocorticoides después de su administración crónica y, con menor frecuencia, c) por tumores, traumatismos o defectos congénitos de la hipófisis (Van Lanen, Sande, 2014). Cuando la deficiencia es tan sólo de glucocorticoides, se denomina “enfermedad de Addison atípica”. El hipoadrenocorticismo secundario siempre es atípico, aunque cabe destacar que el hipoadrecnocorticismo primario se comporta como atípico en las primeras etapas de la enfermedad, antes de la destrucción de la zona glomerular (Greco, 2007).
Esta enfermedad es frecuente que se presente en perros, en particular en hembras jóvenes (70 %) de cualquier raza. Se alude a una base genética. Las razas en las cuales se conoce una predisposición son el Poodle estándar, el Collie barbado, el Perro de agua portugués y el Retriever de Nueva Escocia (Van Lanen, Sande, 2014). Se puede presentar en gatos de cualquier raza, no se ha encontrado una predilección por sexo, y la edad media al momento del diagnóstico es de 4 años (Redden, 2005).
Los signos compatibles con hipoadrenocorticismo incluyen vómitos intermitentes, diarrea, pérdida de peso, letargo, depresión, anorexia y debilidad. Puede haber una historia de vómitos o diarrea que responde al tratamiento no específico, tales como líquidos intravenosos, sólo para que se vuelvan a producir signos varios días o semanas después. En etapas tempranas los signos clínicos son intermitentes. Sin embargo, a medida que la enfermedad progresa, el animal puede presentar hipotermia, temblores, poliuria y polidipsia. La presencia de melena y la pérdida de pelo son hallazgos inusuales (Meeking, 2007).
El examen físico de los animales con enfermedad de Addison en una crisis aguda, se caracteriza por presentar pulso débil, bradicardia, prolongación del tiempo de llenado capilar, depresión severa y debilidad muscular (Meeking, 2007). Las características clínicas que deberían aumentar el índice de sospecha de hipoadrenocorticismo incluyen un ritmo cardíaco normal o lento ante un inminente choque circulatorio, respuesta previa al tratamiento con corticoesteroides y terapia de líquidos (Greco, 2007).
Las alteraciones electrolíticas clásicas —hiponatremia, hipercalemia, hipocloremia— y la relación sodio-potasio menor a 27:1 (Feldman, Nelson, 2004), son muy sugerentes de hipoadrenocorticismo primario (Greco, 2007). Sin embargo, habrá que considerar diagnósticos diferenciales adicionales, como enfermedad inflamatoria intestinal, insuficiencia renal aguda e hiperazotemia posrenal. La hiperazotemia e hiperfosfatemia también se generan en el hipoadrenocorticismo primario, por lo que sería difícil de diferenciar de una insuficiencia renal aguda. La hiperazotemia asociada con hipoadrenocorticismo es de origen prerrenal como resultado de la deshidratación, hipovolemia o hemorragia gastrointestinal (Van Lanen, Sande, 2014).
Además, como resultado de la hemoconcentración se puede observar hipercalcemia hasta en 30% de los perros con hipoadrenocorticismo. Asimismo, la acidosis metabólica resulta de la disminución en la secreción de iones de hidrógeno en el túbulo distal renal, así como del aumento de la generación de ácidos, debido a la disminución de la perfusión tisular, y la retención renal de ácidos orgánicos (Greco, 2007). Los animales que sólo cursen con deficiencia de glucocorticoides pueden presentar hipoglucemia a consecuencia de la gluconeogénesis y la glucogenolisis deteriorada, pero no mostrarán los desequilibrios de electrolitos clásicos (Silverstein, 2015).
Los hallazgos hematológicos incluyen anemia normocítica normocrómica leve (no regenerativa). Empero, durante la etapa de deshidratación, tal vez no se identifique una anemia ligera, debido a la eritrocitosis relativa. Si en la hiperazotemia e hipercalemia, la orina está diluida, es posible que el hipoadrenocorticismo fácilmente se confunda con insuficiencia renal aguda. Se requieren pruebas hormonales para confirmar la enfermedad suprarrenal o para diferenciarla de la insuficiencia renal (Van Lanen, Sande, 2014).
Manejo inicial
Se hospitalizó a la paciente, se instauró terapia de líquidos iv con solución Hartmann; la dosis de la terapia se calculó, tanto para mantenimiento como para evitar la deshidratación a 6%. Además, la paciente fue medicada con omeprazol (1 mg/kg iv sid), ampicilina (22 mg/kg iv tid), citrato de maropitant (1 mg/kg sc sid), ácidos grasos omega 3 (400 UI totales po sid) y sucralfato (500 mg totales po con los alimentos.) Al segundo día de hospitalización la paciente vomitó en una vez; entonces se cambio la terapia de líquidos iv a una solución NaCl 0.9 %, y la presión arterial fue de 186/100 (145). Se repitió la medición de creatinina sérica, la cual regresó a valores de referencia 62 µmol/L (44-159 µmol/L). Del tercer al cuarto día de hospitalización la paciente se mantuvo estable con terapia de líquidos iv con solución NaCl 0.9% a dosis de requerimientos de mantenimiento, con la misma medicación.
 4. ¿Qué prueba diagnóstica se recomienda para confirmar el diagnóstico?
4. ¿Qué prueba diagnóstica se recomienda para confirmar el diagnóstico?
El diagnóstico de hipoadrenocorticismo primario se basa en los signos clínicos, los desequilibrios de electrolitos clásicos y la confirmación con una prueba de respuesta a la estimulación con acth (Van Lanen, Sande, 2014). Para realizar la prueba, se obtiene una muestra de suero antes de la administración de acth, una muestra una hora después si se administra corticotropin (a 0.5 U/kg iv o im) o dos horas después si se administra acth porcina en gel (2.2 U/kg im) (Meeking, 2007).
Para confirmar el diagnóstico se evalúa la cortisolemia pos-acth. Como la concentración sérica de cortisol se registró según los valores de referencia pos-acth, entonces se descarta insuficiencia adrenocortical. Se confirma el hipoadrenocorticismo cuando existe una respuesta inadecuada, caracterizada por valores de cortisolemia pos-acth < 55.18 nmol/L (< 2 µg/dl) (Feldman, Nelson, 2004).
Para identificar si el hipoadrenocorticismo es primario o secundario se recomienda medir la acth plasmática antes de la administración de cualquier corticosteroide. La muestra se debe colectar en un tubo de edta. Es necesario centrifugarla en el transcurso de la primera hora, después de haber tomado la muestra, y almacenarla en tubos de plástico (Feldman, Nelson, 2004).
Un valor de acth plasmática > 400 pg/ml indicará que el origen del hipoadrenocorticismo es primario, pues la producción de acth aumenta de manera compensatoria, mientras un valor de acth plasmática < 10 pg/ml o indetectable, diagnosticará hipoadrenocorticismo secundario. Asimismo, la concentración plasmática de acth de 10 - 70 pg/ml en un individuo con sospecha clínica de hipoadrenocorticismo con una cortisolemia post administración de acth < 55.18 nmol/L (< 2 µg/dl) se considera inapropiadamente reducida, por lo que indicaría hipoadrenocorticismo secundario (Feldman, Nelson, 2004).
Confirmación del diagnóstico en el caso clínico
Al quinto día de hospitalización se probó la estimulación con acth porcina a 2.2 UI/kg sc. El valor basal del cortisol fue < 0.18 µg/dL (0.5 - 5.5 µg/dL) y del cortisol dos horas después de la administración de acth fue de < 0.18 µg/dL (5.0 - 17.0 µg/dL). Estos resultados son consistentes con hipoadrenocorticismo (enfermedad de Addison) (Feldman, Nelson, 2004).
 5. ¿Cuál es el tratamiento y seguimiento para esta enfermedad?
5. ¿Cuál es el tratamiento y seguimiento para esta enfermedad?
El tratamiento para una crisis hipoadrenocortical se centra en la recuperación de la perfusión tisular y la corrección de la volemia con terapia de líquidos endovenosa para corregir los desequilibrios electrolíticos, la hipoglucemia (en caso de producirse) y la restauración del balance ácido-base (Van Lanen, Sande, 2014).
La suplementación de mineralocorticoides, mediante la administración de fludrocortisona oral (0.1 mg/4.5 kg po sid) o pivalato de desoxicorticosterona (pdoc) (2 mg/kg cada 25 días), se iniciará al tener los resultados de la prueba de estimulación con acth, que confirmen la presencia de hipoadrenocorticismo (Feldman, Nelson, 2004). Los suplementos de glucocorticoides se comenzarán a administrar cuando se aplique pdoc, ya que este fármaco no tiene actividad glucocorticoide. Los glucocorticoides de elección son prednisona o prednisolona (0.2 - 0.25 mg/kg po sid); se suministrarán dosis más altas, hasta 0.45 mg/kg po sid (Feldman, Nelson, 2004), si la paciente las requiriere para compensar la falta de corticoesteroides.
Durante el seguimiento de la terapia, la dosis de glucocorticoides puede reducirse a la más baja necesaria para prevenir la semiología asociada a la enfermedad de Addison y a los efectos secundarios de los glucocorticoides como poliuria, polidipsia, polifagia y jadeo (Van Lanen, Sande, 2014). En cambio, la fludrocortisona activa los glucocorticoides, por lo tanto, la suplementación con prednisolona sólo es necesaria en aproximadamente 50% de los perros (Feldman, Nelson, 2004). Todos los perros con estrés por cirugía electiva, estancia en pensión, etc., deberán recibir corticosteroides adicionales. La mayoría de estos perros requieren pdoc cada 25 días, para determinarlo se usarán los resultados de la evaluación de electrolitos con el fin de determinar el intervalo de dosificación óptimo (Greco, 2007).
Todo perro tratado con pdoc requiere supervisión mediante examen físico y la medición de electrolitos, urea y creatinina. Tales controles deberán realizarse a los 12 y 25 días después de las primeras dos o tres administraciones de pdoc. Las metas de la terapia son normalizar los parámetros sanguíneos y recuperar la salud de la paciente. Si continúan las alteraciones electrolíticas se aumentará la dosis de pdoc de 5 a 10% en la siguiente dosis.
Los controles a los 12 y 40 días sirven para evaluar si la dosis es adecuada, mientras que los controles de los días 25 y 50 permiten determinar si la frecuencia de administración es adecuada. Por lo tanto, en caso de que los electrolitos sean normales al día 12, pero anormales al día 25, se deberá reducir el intervalo entre inyecciones. Si los electrolitos son normales al día 25, se puede aumentar el intervalo de administración un día cada ciclo (Feldman, Nelson, 2004).
Tratamiento y seguimiento de la paciente
A esta paciente se le administró pdoc en dosis de 2.2 mg/kg im y se le inició en terapia con prednisona a 0.5 mg/kg po sid. Nueve días después de haber iniciado el tratamiento con pdoc acudió a revisión; no se encontraron alteraciones ni en la historia clínica ni en el examen físico general y se tomó una gasometría control (cuadro 7). Con el objetivo de encontrar la dosis más baja de corticosteroides adecuada para la paciente, se redujo la dosis de prednisona a 0.2 mg/kg po sid. Los días 14 y 24 post administración de pdoc se revisó a la paciente y no se encontraron alteraciones en la historia clínica, ni en el examen físico general y cada uno de estos dos días se le practicaron nuevamente gasometrías (cuadro 7).
Cuadro 7. Resultado de las gasometrías (sangre venosa) efectuadas a una perra con enfermedad de Addison posteriores a la primera administración de pivalato de desoxicorticosterona (pdoc).
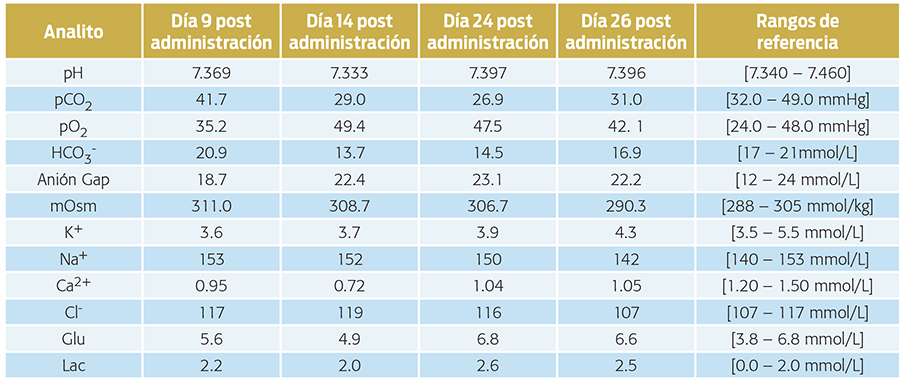
Posteriormente, la paciente se mantuvo con prednisona al 0.2 mg/kg po sid y se le administraron la segunda, tercera y cuarta dosis de pdoc a 2.2 mg/kg sc a intervalos de 26, 32 y 28 días. En todos los casos, antes de cada administración del fármaco se tomó una gasometría como control (cuadro 7). Con la información aportada por los valores plasmáticos de electrolitos se estableció que, en esta paciente, el intervalo de administración del pdoc sería cada 28 días, continuaría con prednisona (0.2 mg/kg po sid) y se realizaría la gasometría control a los tres y seis meses.
 6. ¿Cuáles son el pronóstico y la evolución esperados en la paciente?
6. ¿Cuáles son el pronóstico y la evolución esperados en la paciente?
El pronóstico de los perros con hipoadrenocorticismo es excelente, sin importar el mineralocorticoide seleccionado, siempre y cuando se identifiquen y se respeten la dosis y la frecuencia (Feldman, Nelson, 2004). La calidad y la expectativa de vida serán las mismas que la de un perro sin esta enfermedad (Van Lanen, Sande, 2014).
Lo principal para asegurar un buen pronóstico en un paciente con hipoadrenocorticismo es la educación del propietario (Feldman, Nelson, 2004). Es importante que los propietarios comprendan que sus perros responden de manera inapropiada al estrés, por lo que se les recomendará anticipar si su mascota estará en una situación de estrés (por ejemplo: un procedimiento quirúrgico, si estará en pensión o si está cursando con una enfermedad extra adrenal) y entonces contar con glucocorticoides para administrárselos en ese momento, o bien, incrementar la dosis en caso de que ya se estén administrando (Feldman, Nelson, 2004; Van Lanen, Sande, 2014). Es vital que el propietario sepa: reconocer los signos clínicos de una crisis hipoadrenal, que esta enfermedad necesita manejo médico de por vida, y que las revisiones médicas y las pruebas de laboratorio frecuentes son indispensables (Van Lanen, Sande, 2014).
Financiamiento
El financiamiento de este caso clínico fue cubierto por el propietario de la paciente.
Agradecimientos
Los autores agradecen el apoyo del MC Valentín Sánchez Pedraza, del Servicio de Endocrinología del Hospital General de México.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Contribución de los autores
Joaquín Aguilar y José David Estrada: clínicos responsables de la paciente en el hospital y de la escritura del artículo.
Referencias
1) Feldman E, Nelson R. 2004. Endocrinología y reproducción canina y felina. 3a ed. St. Louis, Missouri, EUA: Elsevier Saunders.
2) Greco DS. 2007. Hypoadrenocorticismo in smal animals. Clinical Techniques in Small Animal Practice, 22:32-35.
3) Van Lanen K, Sande A. 2014. Canine hypoadrenocorticismo: Pathogenesis, diagnosis, and treatment. Topics in Companion Animal Medicine. Vol. 29, Issue 4: 87-116.
4) Meeking S. 2007. Treatment of acute drenal insufficiency. Clinical Techniques in Small Animal Practice, 22:36-39.
5) Silverstein D. 2015. Small animal critical care medicine. 2a ed. St. Louis, Missouri, USA: Elsevier.
6) Redden B. 2005. Feline hypoadrenocorticism. Compendium, Article # 4:697-706.
 Reto Diagnóstico:
Reto Diagnóstico:
Medicina Interna en un Perro Adulto
Resumen
Descripción del caso: Una perra mestiza de 9 años de edad, con historia de tres semanas de hiporexia, debilidad y heces pastosas.
Hallazgos clínicos: En el examen físico presentó 6% de deshidratación, mucosas hiperémicas, condición corporal 2/5, gingivitis, sarro dental y halitosis. Las pruebas de laboratorio demostraron linfocitosis, hipercalemia, hiponatremia, hipocloremia, hiperazotemia con una densidad urinaria de 1.029, disminución en la relación sodio/potasio y una respuesta disminuida en la estimulación con hormona adrenocorticotrópica (acth).
Tratamiento y evolución: Tanto las alteraciones clínicas como clínico-patológicas son consistentes con hipoadrenocorticismo o enfermedad de Addison, por lo que en un inicio se instauró un tratamiento con terapia de líquidos IV por cuatro días y terapia farmacológica de soporte. Posteriormente se administró un mineralocorticoide (pivalato de desoxicorticosterona) con un corticoesteroide (prednisona) por vía oral para el manejo a largo plazo.
Relevancia clínica: El diagnóstico de hipoadrenocorticismo es uno de los retos diagnósticos a los que se enfrentan los médicos veterinarios, ya que las alteraciones clínicas y los resultados de laboratorio son similares a los de otras enfermedades. Además, es importante señalar que en México no es fácil tener acceso a la acth, para realizar la prueba que confirma esta enfermedad, o a los mineralocorticoides como el pivalato de desoxicorticosterona para el tratamiento a largo plazo.
Palabras clave: hipoadrenocorticismo, enfermedad de Addison, pivalato de desoxicorticosterona, prednisona, acth.
Abstract
Case report: Mixed breed, 9-year-old female dog, with a 3-week history of hyporexia, weakness, and pasty stools.
Clinical findings: During the physical exam the bitch showed dehydration (6%), hyperemic mucosae, body condition score 2/5, gingivitis, dental tartar, and halitosis. The laboratory tests showed lymphocytosis, hyperkalemia, hyponatremia, hypochloremia, azotemia, with a urine specific gravity of 1.029, decreased sodium/potassium ratio and reduced response to the adrenocorticotropic hormone (acth) stimulation test.
Treatment and evolution: The clinical signs and the clinicopathological results are consistent with hypoadrenocorticism or Addison’s disease. The initial treatment included intravenous fluids and drug support therapy for 4 days, followed up with a mineralocorticoid (pivalate desoxycorticosterone), and oral corticosteroid (prednisone), to initiate a long-term medical management.
Clinical relevance:The diagnosis of hypoadrenocorticism is a common challenge for small animal veterinarians because clinical signs and laboratory results are similar to other endocrine diseases. It is important to mention that in Mexico, it is difficult to acquire either the acth used to confirm the disease or the mineralocorticoid pivalate desoxycorticosterone for long-term treatment.
Keywords: hypoadrenocorticism, Addison’s disease, pivalate desoxycorticosterone, prednisone, acth.
Reto Diagnóstico:
Distribuido bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0)