 Reto Diagnóstico:
Reto Diagnóstico:
Necropsia de un huevo de cacatúa
de las Molucas (Cacatua moluccensis)
Carles Juan-Sallés1*
Jorge Rosell1
Mireia Máinez2
1 Noah's Path
Arq. Santiago Pérez Aracil 30 bajo
03203 Eleche, Alicante, España
2 Centro Veterinario La Marina Exóticos
Arq. Santiago Pérez Aracil 30 bajo
03203 Eleche, Alicante, España
*Autor para correspondencia:
Tel: + 34 695561515
Correo electrónico: noahspath.cjuansalles@gmail.com
Recibido: 2015-06-19
Aceptado: 2015-11-04
Publicado: 2015-11-27
Información y declaraciones adicionales aquí
Derechos de autor: Carles Juan-Sallés et al. 2015
 Distribuido bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0)
Distribuido bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0)
Historia clínica
Un criador de psitácidas constató que en uno de los huevos de cacatúa de las
Molucas (Cacatua moluccensis) en incubación artificial se produjo muerte embrionaria a término, por lo que nos lo remitió para practicarle la necropsia. El huevo había sido incubado artificialmente junto con otro de su misma especie y de los mismos progenitores. En la incubadora había simultáneamente huevos de otras especies de psitácidas, incluidos guacamayos y loros grises africanos (Psittacus e. erithacus). Según el criador, los huevos de las otras especies habían estado eclosionando sin problemas.
Se practicó la necropsia según una adaptación del protocolo de necropsias de huevos aviares utilizado en la Zoological Society of San Diego, incluida la determinación del estadio de desarrollo embrionario según lo establecido para el pollo doméstico (Hamburger, Hamilton, 1951). El huevo pesaba 24 g, el cascarón estaba completamente libre de excremento y concreciones, y tenía unas dimensiones mayores de 45.23 x 34.01 mm (figura 1), obtenidas mediante calibrador digital. El grosor del cascarón era de 0.28–0.29 mm. Cuando se abrió la cámara de aire, se observó que su membrana interna (mica) no estaba incidida y mostraba una zona blanca, opaca, paracentral, bien delimitada (figura 2).

Figura 1. Imagen macroscópica del huevo, previa a su apertura, en la que se demuestra
la ausencia de concreciones y material fecal en el cascarón. Barra = 1 cm.
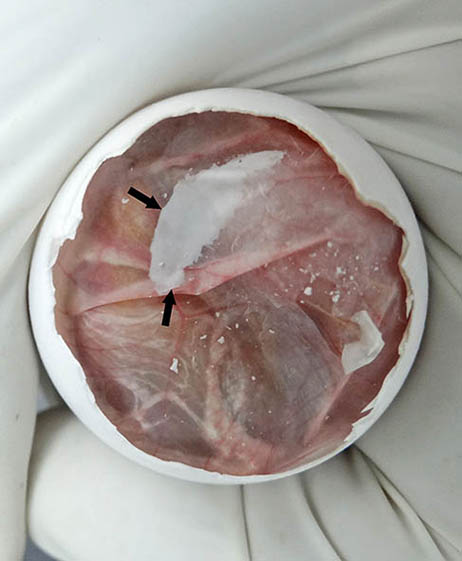
Figura 2. Imagen macroscópica del huevo una vez abierto por el polo de la cámara de aire.
Observe que la membrana interna de la cámara de aire no está incidida y que muestra una zona opaca (flechas).
Una vez abierta la cámara embrionaria, se obtuvieron fotografías macroscópicas del embrión desde diversos ángulos dentro del huevo, y también tras ser extraído (figuras 3-6).
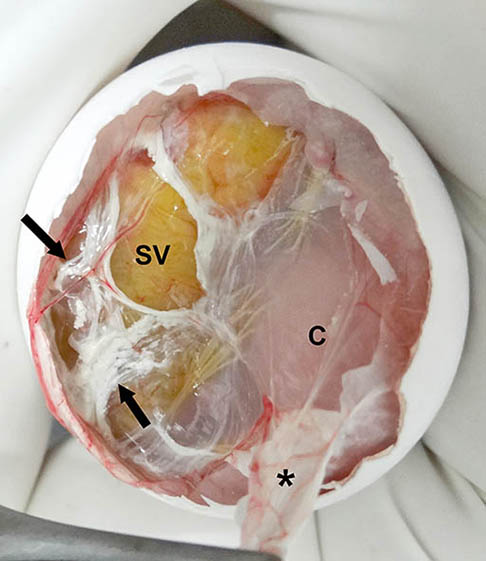
Figura 3. Imagen macroscópica del huevo una vez incidida la membrana interna de la cámara de aire (mica). Se aprecia el saco vitelino (SV) situado bajo la mica. C = cabeza; * = fragmento de la mica parcialmente adherido al corioalantoides.
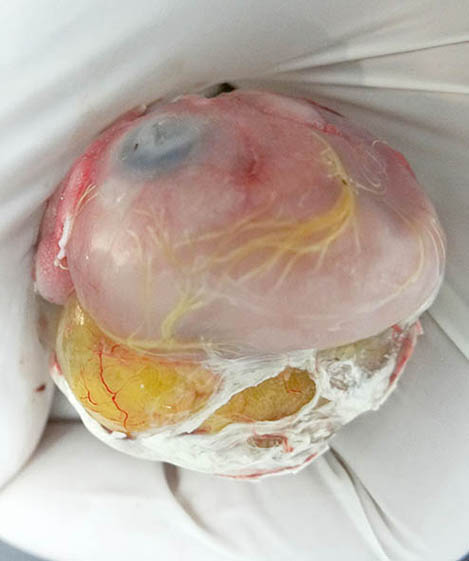
Figura 4. Imagen macroscópica del huevo, vista desde arriba del polo de la cámara de aire, después de haber retirado completamente la membrana interna de la cámara de aire y la mayor parte del cascarón.
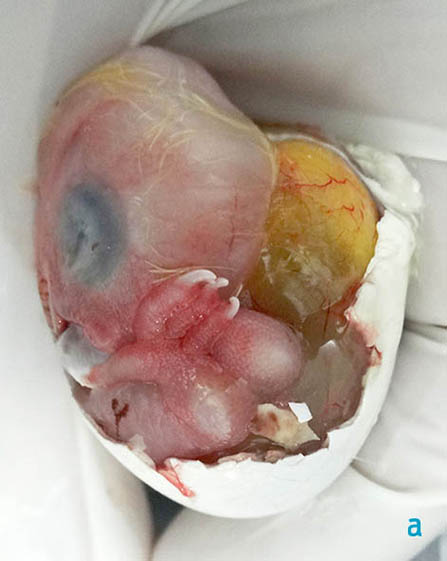
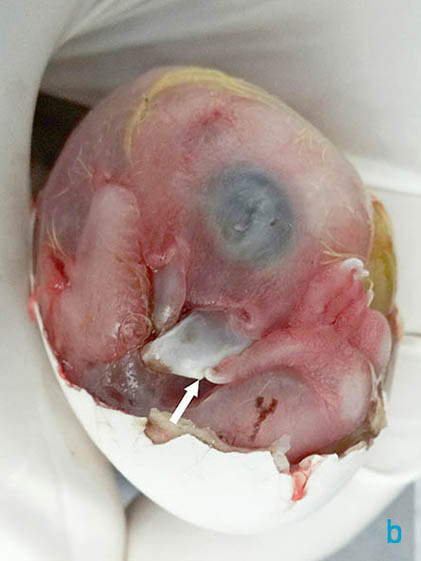
Figura 5 a y b. Imagen macroscópica de la vista lateral del huevo una vez retirada por completo la membrana interna de la cámara de aire (a) y la mayor parte del cascarón (b).
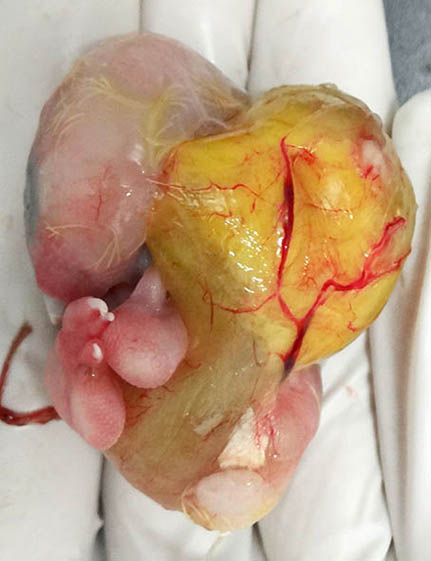
Figura 6. Imagen macroscópica de la vista lateral del huevo sin la membrana de la cámara de aire y sin el cascarón.
La mica estaba moderadamente adherida al corioalantoides (figura 3). El embrión pesaba 21 g y mostraba un saco vitelino casi completamente externo (figuras 5a y 6). Otras características externas del embrión incluían diente del pico (figura 5b), uñas cornificadas (figuras 5 y 6), desarrollo a término de las plumas y párpados totalmente cerrados (figuras 4 y 5), motivos por los que este embrión se dató en el estadio 44 del
desarrollo embrionario.
El estudio histopatológico reveló que las únicas lesiones relevantes consistían en una aspiración de fluido amniótico en los pulmones y mineralización renal tubular multifocal, ambas leves. El ventrículo, ganglios nerviosos viscerales, intestino, uréter, corazón, arterias elásticas (base del corazón), proventrículo, cloaca, piel, orificio cloacal, tráquea, buche, coana, orofaringe, músculos esqueléticos, huesos, glándula de Harder, nervio óptico, timo y saco vitelino estaban histológicamente dentro de los límites de la normalidad.
Preguntas
1. ¿Cuál es tu diagnóstico y cuáles son los principales hallazgos de la necropsia del huevo?
2. ¿Es normal el material blanquecino delimitado con flechas de la figura 3, y en qué estructura extraembrionaria se encuentra?
3. ¿Cuál es el nombre y función de la estructura señalada con una flecha blanca en la figura 5b?
 1. ¿Cuál es tu diagnóstico y cuáles son los principales hallazgos de la necropsia del huevo?
1. ¿Cuál es tu diagnóstico y cuáles son los principales hallazgos de la necropsia del huevo?
Malposición embrionaria en una cacatúa de las Molucas (Cacatua moluccensis).
Cuando abrimos el huevo por el polo de la cámara de aire, y tras incidir y retirar la membrana interna de esta cámara (mica), apreciamos que el saco vitelino se había desplazado a la posición laterodorsal por detrás de la extremidad inferior izquierda, justo por debajo de la mica (figuras 7, 8 y 9), apoyado sobre el flanco izquierdo, y el lado izquierdo del cuello y cabeza del embrión.
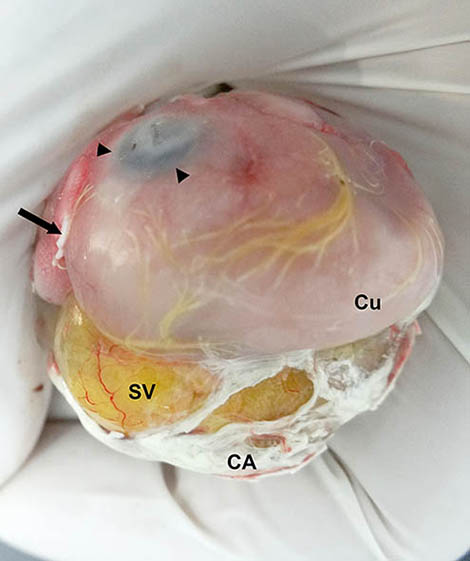
Figura 7. Imagen macroscópica del huevo sin la membrana interna de la cámara de aire y sin la mayor parte del cascarón, vista desde arriba del polo de la cámara de aire. En esta toma, se constata la malposición del saco vitelino (SV), que desplaza medialmente a la cabeza y el cuello (Cu). CA = corioalantoides con excretas urinarias; las cabezas de flecha señalan el ojo derecho, y la flecha negra, las uñas cornificadas de la extremidad posterior derecha, que quedan mal posicionadas sobre el dorso de la cabeza.
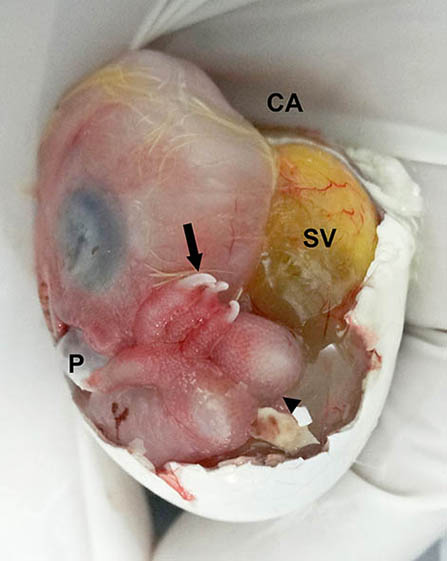
Figura 8. Imagen macroscópica de la vista lateral del huevo sin la membrana interna de la cámara de aire y sin la mayor parte del cascarón. En esta toma se ilustra el desplazamiento laterodorsal del saco vitelino (SV), de forma que la cabeza, el cuello y la extremidad posterior izquierda (cabeza de flecha) quedan desplazados hacia el lado opuesto. CA = zona de la cámara de aire; P = pico. La flecha negra apunta a una de las uñas cornificadas de los dedos de la extremidad posterior derecha, la cual está situada de forma incorrecta sobre el dorso de la cabeza.
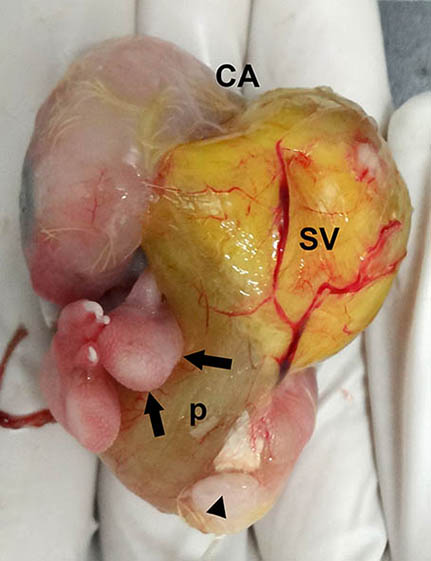
Figura 9. Imagen macroscópica de la vista lateral del embrión sin la membrana interna de la cámara de aire y sin el cascarón. Esta imagen demuestra con mayor detalle el desplazamiento del saco vitelino (SV) laterodorsalmente y cómo el pedículo del saco vitelino (p) eleva a la extremidad posterior izquierda al situarse caudalmente a la misma (flechas). CA = zona de la cámara de aire; la cabeza de flecha señala el orificio cloacal.
El saco vitelino se situaba caudal a la cara posterior del tibiotarso izquierdo y esto elevó la extremidad posterior izquierda, que además fue desplazada hacia el eje sagital del embrión, y retraída contra el cuerpo del embrión y sobre el ojo izquierdo (figuras 8 y 9).
Además, la cabeza y el cuello también se desplazaron hacia la derecha del eje axial embrionario (figuras 7, 6 y 9), de forma que el pico quedaba en una de las zonas más distantes de la parte baja de la mica) (figura 8). La cabeza se situaba sobre el ala derecha y el extremo distal del ala quedaba bajo el cuello, mientras que la extremidad posterior derecha se apoyaba parcialmente sobre la cabeza y el pico (figuras 8 y 10). El ala izquierda también quedó replegada bajo el cuello.
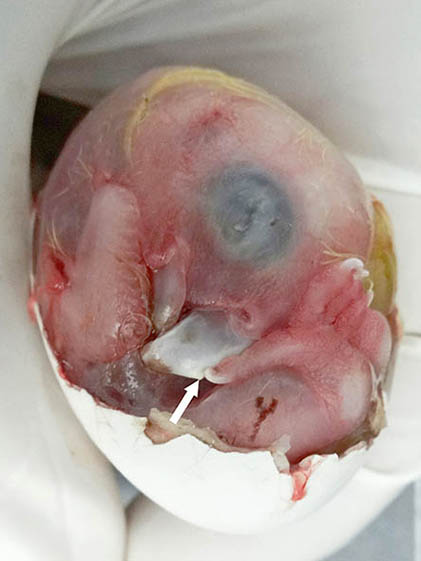
Figura 10. Imagen macroscópica de la vista lateral del huevo una vez retiradas por completo, la membrana interna de la cámara de aire y la mayor parte del cascarón. La flecha blanca señala al diente de pico.
En condiciones normales, en un embrión que llega a término, el saco vitelino debe hallarse recostado en el polo opuesto al de la cámara de aire con ambas extremidades posteriores a cada lado del saco vitelino y bajo la zona dorsolateral izquierda del cuello y cráneo. Entonces, la cabeza gira hacia la derecha y se sitúa bajo el ala derecha (excepto en especies con escaso desarrollo de esta última), con el pico apuntando hacia la cámara de aire justo por debajo de la parte más baja de la mica), y el eje axial del embrión es paralelo al eje longitudinal mayor del huevo (Hamburger, Hamilton, 1951; Rideout, Kuehler, 2000; Elibol, Brake, 2006).
 2. ¿Es normal el material blanquecino delimitado con flechas de la figura 3, y en qué estructura
extraembrionaria se encuentra?
2. ¿Es normal el material blanquecino delimitado con flechas de la figura 3, y en qué estructura
extraembrionaria se encuentra?
El material blanquecino delimitado con flechas en la figura 11, corresponde a uratos excretados de forma normal hacia la membrana corioalantoidea.
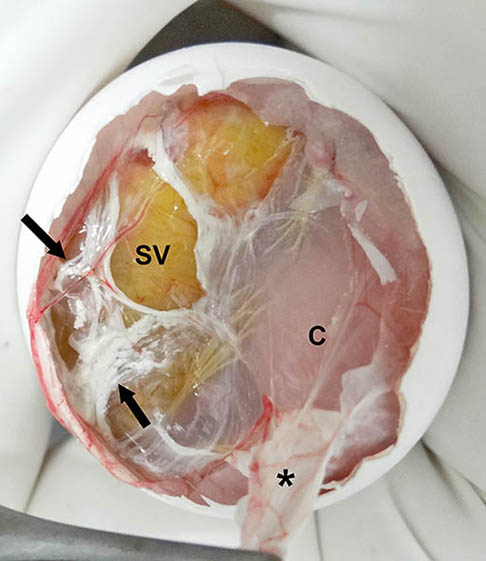
Figura 11. Imagen macroscópica del huevo sin la membrana interna de la cámara de aire (mica). Se aprecia que la posición del saco vitelino (SV) es inadecuada, ya que se sitúa bajo la mica). C = cabeza; * = fragmento de la mica) parcialmente adherido al corioalantoides. Las flechas negras señalan los uratos excretados al corioalantoides.
 3. ¿Cuál es el nombre y función de la estructura señalada con una flecha blanca en la figura 6?
3. ¿Cuál es el nombre y función de la estructura señalada con una flecha blanca en la figura 6?
La estructura señalada con una flecha blanca en la figura 6 se denomina diente del pico y su función consiste en la incisión de la mica y la ruptura del cascarón en la eclosión.
Relevancia clínica
La malposición embrionaria descrita es suficientemente grave como para impedir la eclosión interna (incisión de la mica) y, por lo tanto, para causar muerte por hipoxia, pues el embrión no logra acceder a la bolsa de oxígeno.
El pico está en una de las zonas más alejadas de la parte baja de la mica, lo que, unido al limitado movimiento de la cabeza por el desplazamiento del saco vitelino, justo debajo de la parte baja de la mica y de la extremidad posterior derecha sobre el dorso de la cabeza, hacen imposible la incisión de la mica. Por ejemplo, una rotación del eje embrionario que aleje el pico de la parte baja de la mica, o la malposición de una pata sobre la cabeza, ya son causa, sin necesidad de alteraciones adicionales, de mortalidades moderadas a elevadas (Rideout, Kuehler, 2000). La aspiración de fluido amniótico observada durante el examen histopatológico es frecuente en embriones con malposiciones en la casuística examinada por uno de los autores (Juan-Salles). El diagnóstico obtenido mediante la necropsia del huevo permitió intervenir después en el proceso de eclosión del otro huevo de la misma pareja, en el cual no se estaba dando el proceso de eclosión interna de forma normal, presumiblemente también por una malposición.
En un huevo de la siguiente puesta de la misma pareja, pero incubado con modificaciones al protocolo de volteo, tampoco se produjo la eclosión. Este huevo contenía un embrión a término (en estadio de desarrollo similar al estudiado en la necropsia), que mostraba edema subcutáneo grave en el cuello y la cabeza, lo cual causó reducción intensa del volumen de la cámara de aire. A este embrión también le fue diagnosticada una malposición consistente en un desplazamiento excesivamente ventral del saco vitelino, de forma que el embrión mostraba una alineación anormal de su eje axial y la cabeza estaba colocada sobre el ala derecha. Este embrión tampoco llegó a incidir la mica. Aunque la malposición de la cabeza sobre el ala derecha con frecuencia no es letal (Rideout, Kuehler, 2000), la malposición adicional del saco vitelino, del eje axial embrionario y el edema subcutáneo, en conjunto, contribuyeron a la falta de eclosión interna que provocó la muerte. En este sentido, una humedad de incubación demasiado elevada habitualmente causa edema subcutáneo, incrementa la mortalidad embrionaria y los pollos que llegan a eclosionar muestran una mayor mortalidad en los primeros días de vida (Rideout, Kuehler, 2000; Romanoff, 1972).
El criador, tras los hallazgos en estos estudios de necropsia y la recomendación de revisar y modificar el protocolo de incubación, utilizó cuatro incubadoras con ajuste a diferentes humedades (45%, 50% y 65%), en lugar de incubar todos los huevos al 45%. También pesó los huevos diariamente para ajustar la humedad si era necesario. En cuanto al volteo, decidió voltear los huevos 180º cada dos horas, en lugar de 90º cada hora. Tras estos cambios, los siguientes huevos comenzaron a eclosionar sin problemas.
Las malposiciones embrionarias son una de las causas más frecuentes de mortalidad en embriones de aves domésticas y salvajes en los estadios E40-45 (embriones en preparación para la eclosión o en eclosión) y se deben habitualmente a unos parámetros de volteo y posición del huevo en la incubadora inadecuados o subóptimos para la especie (Rideout, Kuehler, 2000; Juan-Sallés et al., 2006; Elibol, Brake, 2006; Romanoff, 1972). Un exceso continuo de CO2 en la incubadora también genera malposiciones, en especial de patas dobladas alrededor del cuello (Romanoff, 1972).
Este caso ilustra de forma práctica las aplicaciones de la patología de huevos aviares en los programas de propagación en cautiverio, ya que puede contribuir a detener los problemas de mortalidad embrionaria como en estas cacatúas, e incluso llegar a ser esencial para el éxito reproductivo de especies amenazadas como, por ejemplo, el pavón (Oreophasis derbianus) (Juan-Sallés et al., 2006; Elibol, Brake, 2006; Romanoff, 1972; Rosas-Rosas et al., 2008).
Financiamiento
El financiamiento de este caso clínico fue cubierto por el propietario del paciente.
Agradecimientos
Los autores agradecen a los criadores la autorización para la descripción de este caso en la bibliografía y la aportación de los datos de incubación en cuanto al cambio de protocolo tras el diagnóstico en este huevo y los resultados de dicho cambio.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Contribución de los autores
Carles Juan-Sallés: patólogo responsable del diagnóstico, escritura del artículo y trabajo fotográfico.
Jorge Rosell: patólogo residente, apoyo en la realización de la necropsia, procesado del embrión para histopatología, y formato y revisión del manuscrito.
Mireia Máinez: clínica responsable del criadero y revisión del manuscrito.
Referencias
1) Hamburger V, Hamilton Hl. 1951. A series of normal stages in the development of the chick embryo. Journal of Morphology, 88:49-91.
2) Rideout BA, Kuehler CM. 2000. Pathology of the avian embryo: what veterinarians need to know about pathology as a disease surveillance tool for avian captive propagation programs. Proceedings of American Association of Zoo Veterinarians, 329-334.
3) Juan-Sallés C, Parás A, Marquès H, Garner MM. 2006. Causes of embryonic mortality in an aviary: 72 cases. Proceedings of the European Association of Zoo and Wildlife Veterinarians, 187-190.
4) Elibol O, Brake J. 2006. Effect of egg turning angle and frequency during incubation on hatchability and incidence of unhatched broiler embryos with head in the small end of the egg. Poultry Science, 85:1433-437.
5) Romanoff AL, Romanoff AJ. 1972. Pathogenesis of the Avian Embryo: An Analysis of Causes of Malformations and Prenatal Death. New York: Wiley-Interscience.
6) Rosas-Rosas AG, Cornejo J, Juan-Sallés C, Garner MM. 2008. Perinatal mortality in a colony of captive horned guans (Oreophasis derbianus). Proceedings of American Association of Zoo Veterinarians and Association of Reptile and Amphibian Veterinarians Joint Conference, 136-137.
 Reto Diagnóstico:
Reto Diagnóstico:
Necropsia de un huevo de cacatúa
de las Molucas (Cacatua moluccensis)
Resumen
Descripción del caso: Un criador de psitácidas constató que en uno de los huevos de cacatúa de las Molucas (Cacatua moluccensis) en incubación artificial se produjo muerte embrionaria a término y nos lo remitió para practicarle la necropsia. Dicho huevo había sido incubado artificialmente junto con otro de su misma especie y de los mismos progenitores. En la incubadora había simultáneamente huevos de otras especies de psitácidas, incluidos guacamayos y loros grises africanos (Psittacus e. erithacus). Según el criador, los huevos de las otras especies habían estado eclosionando sin problemas.
Hallazgos en la necropsia: Al abrir el huevo por el polo de la cámara de aire, y tras incidir y retirar su membrana interna (mica), se confirmó que la cámara embrionaria contenía un embrión datado en el estadio 44 del desarrollo embrionario. Se pudo apreciar que el saco vitelino se había desplazado laterodorsalmente por detrás de la extremidad inferior izquierda, de forma que quedaba situado a la izquierda del embrión justo por debajo de la mica, apoyado sobre el flanco izquierdo del mismo. Además, la cabeza y el cuello también se desplazaron hacia la derecha del eje axial embrionario, y de esta manera, el ala izquierda quedó replegada bajo el cuello. El estudio histopatológico reveló que las únicas lesiones relevantes consistían en una aspiración de fluido amniótico en los pulmones y mineralización renal tubular multifocal, ambas leves.
Diagnóstico patológico: Malposición embrionaria suficientemente grave como para impedir la eclosión interna (incisión de la mica) y, por lo tanto, causar la muerte por hipoxia. La aspiración de fluido amniótico observada durante el examen histopatológico es frecuente en embriones con malposiciones y se atribuye a la hipoxia causada por el fallo de la eclosión interna.
Relevancia clínica: Las malposiciones embrionarias son una de las causas más frecuentes de mortalidad en embriones que se preparan para la eclosión o en eclosión (estadios E40-45), y se deben habitualmente a parámetros de volteo y posición del huevo en la incubadora inadecuados o subóptimos para la especie. Este caso ilustra de manera práctica las aplicaciones de la patología de huevos aviares en los programas de propagación en cautiverio.
Palabras clave: malposición embrionaria, necropsia de huevo aviar, cacatúa de las Molucas, Cacatua moluccensis.
Abstract
Case report: A Moluccan cockatoo (Cacatua moluccensis) egg was received for necropsy with a history of late embryo death. It had been artificially incubated along with another egg from the same breeding pair, and eggs from other psittacine species including macaws and African grey parrots (Psittacus e. erithacus). According to the breeder, eggs from the other species had been hatching normally.
Gross findings: after opening the egg at the blunt (aircell) end and removing the inner aircell membrane (iam), a stage 44 embryo was found in the embryonic compartment. The yolk sac was malpositioned to the left side of the embryo and its left leg, underneath iam. Additionally, the head and neck were displaced to the right and the left wing was displaced under the neck. Histopathological examination revealed mild aspiration of amniotic fluid in the lungs and renal tubular mineralization.
Pathological diagnosis: Embryonic malposition severe enough to impede aircell pipping and, thus, to cause death due to hypoxia. Amniotic fluid aspiration is frequent in malpositioned avian embryos and is attributed to hypoxia resulting from the failure in aircell pipping.
Clinical relevance:Embryonic malpositions are one the most frequent causes of late embryos in preparation for hatching or during hatching (stages 40 to 45) and are usually due to inadequate or suboptimal turning and position of the eggs in the incubators. This case illustrates applications of avian egg necropsy in captive breeding programs.
Keywords: avian egg necropsy, embryo malposition, Moluccan cockatoo, Cacatua moluccensis.
Reto Diagnóstico:
Distribuido bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0)