Resumen
Clínica Veterinaria: abordaje diagnóstico y terapéutico
ISSN: 2395-8766
Una forma de citar este artículo:
- Tovar-Dorantes M de J, Díaz-Hernández T, Larios-Barajas MK, Lima-Melo A, Núñez-Ochoa L. Aelurostrongilosis en un gato (Felis silvestris catus) de la Ciudad de México. Clínica veterinaria: abordaje diagnóstico y terapéutico. 2020;6.e57202064. doi: 10.22201/fmvz.23958766e.2020.6.57
Descripción del caso. Gato doméstico macho de cinco meses de edad con taquipnea, dificultad respiratoria y patrón restrictivo con un patrón intersticial no estructurado generalizado observado en el estudio radiográfico de campos pulmonares.
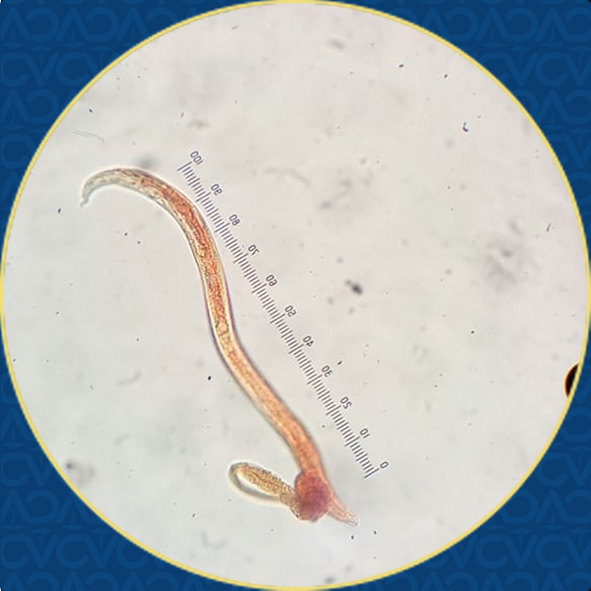
Hallazgos clínicos. El diagnóstico se obtuvo mediante la observación de larvas de Aelurostrongylus abstrusus en el lavado traqueobronquial y se corroboró en heces por la técnica de Baermann seriada.
Tratamiento y evolución. Se eligió un esquema de tratamiento con doxiciclina a 5 mg/kg vía oral cada 12 h por quince días; fenbendazol 50 mg/kg con pamoato de pirantel 20 mg/kg y prazicuantel 5 mg/kg vía oral cada 24 h por tres días consecutivos; prednisolona a 1 mg/kg vía oral cada 12 h dosis reducción por quince días; omeprazol a 1.25 mg/kg vía oral cada 12 h por diez días y pipeta tópica de imidacloprid 10 % y moxidectina 1 % al cuarto día de iniciado el tratamiento. El paciente mostró mejoría clínica.
Pruebas de laboratorio. Los estudios radiográficos de los días 37 y 143 de evolución y el resultado negativo del estudio coproparasitoscópico por la técnica de Baermann seriada los días 53 y 143 de evolución corroboraron la mejora clínica; así el tratamiento fue efectivo.
Relevancia clínica. Este es el segundo caso informado en México de Aelurostrongylus abstrusus en gatos domésticos y en una ciudad diferente a la del primer caso.
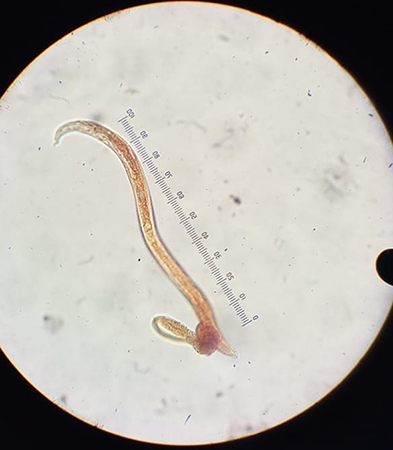
Figura 4. Larva de Aelurostrongylus abstrusus obtenida de lavado traqueobronquial
Aelurostrongylosis in a domestic cat in Mexico City
Abstract
Case description. A 5-month-old, male, indoor-outdoor domestic shorthair cat from Mexico City with cough, tachypnea and respiratory distress. Thoracic radiographs revealed a generalized unstructured interstitial pattern.
Diagnostic and interpretation. Diagnosis of Aelurostrongylus abstrusus was obtained by observing larvae in a tracheobronchial lavage sample and corroborated through Baermann funnel technique.
Treatment and clinical response. The chosen treatment scheme was doxycycline at 5 mg/kg orally every 12 h for 15 days; fenbendazole 50 mg/kg with pyrantel pamoate 20 mg/kg and praziquantel 5 mg/kg orally every 24 h for 3 consecutive days; prednisolone at 1 mg/kg oral every 12 h reduction dose over 15 days; omeprazole at 1.25 mg/kg orally every 12 h for 10 days and topical imidacloprid 10% and moxidectin 1% pippete at fourth day of treatment. The patient had clinical improvement.
Laboratory tests. The patient improvement was corroborated by the radiographic studies on days 37 and 143 of evolution and in the coproparasitoscopic study, by serial Baermann technique, negative on day 53 and 143 of evolution.
Clinical relevance. This is the second case report of Aelurostrongylus abstrusus in domestic cats in Mexico, happening in a different city from the first case.
Referencias
Elsheikha HM, Wright I, Wang B, Schaper R. Prevalence of feline lungworm Aelurostrongylus abstrusus in England. Vet Parasitol Reg Stud Reports 2019;16:100271. doi: 10.1016/j.vprsr.2019.100271.
Hoggard KR, Jarriel DM, Bevelock TJ, Verocai GG. Prevalence survey of gastrointestinal and respiratory parasites of shelter cats in northeastern Georgia, USA. Vet Parasitol Reg Stud Reports. 2019;16:100270. doi: 10.1016/j. vprsr.2019.100270.
Gueldner EK, Gilli U, Strube C, Schnyder M. Seroprevalence, biogeographic distribution and risk factors for Aelurostrongylus abstrusus infections in Swiss cats. Vet Parasitol. 2019; 266:27–33. doi: 10.1016/j.vetpar.2018.12.013.
Echeverry DM, Giraldo MI, Castaño JC. Prevalencia de helmintos intestinales en gatos domésticos del departamento del Quindío, Colombia. Biomédica. 2012;32:430–6. doi: 10.7705/biomedica.v32i3.439.
Oyarzún CJA. Pesquisa de nematodos pulmonares en perros y gatos de las ciudades de río bueno y la unión, provincia del Ranco [memoria de licenciatura]. Valdivia (CL): Universidad Austral de Chile; 2013.
Arlington HS. Aelurostrongylus abstrusus induced pneumonia in cats: pathological and epidemiological findings of 38 cases (1987-1996). Semina: Ciências Agrárias. 2005;26(3):373–80.
Salamanca JA, Gil B, Cortés JA. Parasitosis pulmonar por Aelurostrongylus abstrusus en un felino. Reporte de caso. Rev Med Vet Zoot. 2003;50:30–4.
Sánchez RI, Cabrera GE, Cuellar RJ, Murcia BC, Sánchez ML, Sánchez ME. Diagnóstico post mortem de Aeulorstrongylus abstrusus (Railliet, 1898) en un felino mestizo: primer reporte en el municipio de Florencia, Departamento del Caquetá, Colombia. Redvet Rev Electrón vet [internet]. 2017 [citado 11 marzo 2020];18(5):1–9. Disponible en: http://www.veterinaria.org/revistas/redvet/ n050517/051701pdf
Ricciardi JE, Paludi AE, Castro E. Tos en un felino asociada a parasitosis pulmonar por Aelurostrongylus abstrusus [tesina de licenciatura]. Tandil (AR): Universidad Nacional del Centro de la Provincia de Buenos Aires; 2017.
Bowman DD, Hendrix CM, Lindsay DS, Barr SC. Feline clinical parasitology. US: Blackwell Science Company; 2002.
Ribeiro VM, Lima WS. Larval production of cats infected and re-infected with Aelurostrongylus abstrusus (Nematoda: Protostrongylidae). Rev Méd Vét. 2001;152(11):815-29.
Télles SM. Aelurostrongylus abstrusus en felinos domésticos: reporte de un caso Clínico del Hospital Médico Veterinario de Pequeñas Especies de la Universidad Autónoma del Estado de México [tesis de licenciatura]. Toluca de Lerdo (México): Universidad Autónoma del Estado de México; 1998.
Lautenslager JP. Internal helminths of cats. The Veterinary Clinics of North America. 1976;6:353–65. doi: 10.1016/S0091-0279(76)50054-2.
Traversa D, Guglielmini C. Feline aelurostrongylosis and canine angiostrongylosis: a challenging diagnosis for two emerging verminous pneumonia infections. Vet Parasitol. 2008; 157(3-4):163–74. doi: 10.1016/j.vetpar.2008.07.020.
Hamilton JM, McCaw AW. The role of the mouse in the life cycle of Aelurostrongylus abstrusus. J Helminthol. 1967;41(4):309–12.
Hobmaier M, Hobmaier A. Mammalian phase of the lungworm Aelurostrongylus abstrusus in the cat. J Am Vet Med Assoc. 1935;87:191–8.
Mackerras MJ. Observations on the life history of the cat lungworm, Aelurostrongylus abstrusus (Railliet, 1898) (Nematoda: Metastrongylidae). Aust J Zool. 1957;5(2):88–195. doi: 10.1071/ZO9570188.
Moskvina TV. Current knowledge about Aelurostrongylus abstrusus biology and diagnostic. Ann Parasitol. 2018;64(1):3–11. doi: 10.17420/ap6401.126.
Stockdale PHG. The pathogenesis of the lesions elicited by Aelurostrongylus abstrusus during its prepatent period. Pathol Vet. 1970;7(2):102–15.
Hamilton JM. Aelurostrongylus abstrusus infestation of the cat. Vet Rec. 1963;75(16):417–421.
Scott DW. Current knowledge of aelurostrongylosis in the cat. Cornell Vet. 1973;63(3):483–500.
Soulsby EJL. Helminths, arthropods and protozoa of domesticated animals. London: Bailliere-Tindall; 1982.
Urquhart GM, Armour J, Duncan JL, Dunn AM, Jennings FW. Veterinary Parasitology. Avon (US): Longman Sci and Tech; 1987.
Arlington HS. Aelurostrongylus abstrusus induced pneumonia in cats: pathological and epidemiological findings of 38 cases (1987-1996). Semina: Ciências Agrárias. 2005;26(3):373–80.
Lacava G, Zini E, Marchesotti F, Domenech O, Romano F, Manzocchi S, Venco L, Auriemma E. Computed tomography, radiology and echocardiography in cats naturally infected with Aelurostrongylus abstrusus. J Feline Med Surg. 2017;19(4):446–53. doi: 10.1177/1098612X16636419.
Tüzer E, Toparlak M, Gargili A, Keles Vedat, Ulutas EM. A case of Aelurostrongylus abstrusus infection in a cat in Istanbul, Turkey and its treatment with moxidectin and levamisole. Turk J Vet Anim Sci. 2002;26:411–14.
Douglas P. Common pulmonary diseases in cats. Clinician’s Brief [internet]. 2017 [citado noviembre 2018]: 107–15. Disponible en: https://www.cliniciansbrief.com/article/common-pulmonary-diseases-cats
Willard MD, Roberts RE, Allison N, Grieve RB, Escher K. Diagnosis of Aelurostrongylus abstrusus and Dirofilaria immitis infections in cats from a human shelter. J Am Vet Med Assoc. 1988;192(7):913–6.
Abbate JM, Arfuso F, Gaglio G, Napoli E, Cavalera MA, Giannetto S, Otranto D, Brianti E. Larval survival of Aelurostrongylus abstrusus lungworm in cat litters. J Feline Med Surg. 2018:1098612X18811168.
Foster SF, Martin P, Braddock JA, Malik R. A retrospective analysis of feline bronchoalveolar lavage cytology and microbiology (1995-2000). J Feline Med Surg. 2004;6(3):189–98. doi: 10.1016/j.jfms.2003.12.001.
Ribeiro VM, Barçante JMP, Negrão-Correa D, Barçante TA, Klein A, Lima WS. Bronchoalveolar lavage as a tool for evaluation of cellular alteration during Aelurostrongylus abstrusus infection in cats. Pesq Vet Bras. 2014;34(10):990–5. doi: 10.1590/S0100-736X2014001000011.
Schnyder M, Di Cesare A, Basso W, Guscetti F, Riond B, Glaus T, Crisi P, Deplazes
P. Clinical, laboratory and pathological findings in cats experimentally infected with Aelurostrongylus abstrusus. Parasitol Res. 2014;113(4):1425–33. doi: 10.1007/s00436-014-3783-2.
Center SA, Randolph JF, Erb HN, Reiter S. Eosinophilia in the cat: a retrospective study of 312 cases (1975-1986). J Am Anim Hosp Assoc. 1990;26(4):349–58.
Dirven M, Szatmári V, Van den Ingh T, Nijsse R. Reversible pulmonary hypertension associated with lungworm infection in a young cat. J Vet Cardiol. 2012;14(3):465–74. doi: 10.1016/j.jvc.2012.04.005.
Lappin MR, Blondeau J, Boothe D, Breitschwerdt EB, Guardabassi L, Lloyd DH, Papich MG, Rankin SC, Sykes JE, Turnidge J, Weese JS. Antimicrobial use guidelines for treatment of respiratory tract disease in dogs and cats: antimicrobial guidelines working group of the International Society for Companion Animal Infectious Diseases. J Vet Intern Med. 2017;31(2):279–94. doi: 10.1111/ jvim.14627.
Wareth G, El-Diasty M, Melzer F, Murugaiyan J, Abdulmawjood A, Sprague LD, Neubauer H. Trueperella pyogenes and Brucella abortus coinfection in a dog and a cat on a dairy farm in Egypt with recurrent cases of mastitis and abortion. J Vet Diagn Invest. 2002;14:159–62. doi: 10.1155/2018/2056436.
Vig MM, Murray PA. Successful treatment of Aelurostrongylus abstrusus with fenbendazole. Comp Cont Educ Pract Vet. 1986;8:214–22.
Roberson EL, Burke TM. Evaluation of granulated fenbendazole (22.2 %) against induced and naturally occurring helminth infections in cats. Am J Vet Res. 1980;41(9):1499–502.
Schmid K, Duwel D. Use of fenbendazole (Panacur tablets ad. us. vet.) against helminth infections in cats. Tierarzt Umsch. 1990;45(12):873–5.
Yildiz K, Duru SY, Gokpinar S. Alteration in blood gases in cats naturally infected with Aelurostrongylus abstrusus. J Small Anim Pract. 2011;52(7):376–9. doi: 10.1111/j.1748-5827.2011.01076.x.
Traversa D, Di Cesare A, Milillo P, Lohr B, Iorio R, Pampurini F, Schaper R, Paoletti B, Heine J. Efficacy and safety of imidacloprid 10 %/moxidectin 1 % spoton formulation in the treatment of feline aelurostrongylosis. Parasitol Res. 2009;105:S55–62. doi: 10.1007/s00436-009-1496-8.
Traversa D, Milillo P, Di Cesare A, Lohr B, Iorio R, Pampurini F, Schaper R, Bartolini R, Heine J. Efficacy and safety of emodepside 2.1 %/praziquantel 8.6 % spot-on formulation in the treatment of feline aelurostrongylosis. Parasitol Res 2009;105:S83-9. doi: 10.1007/s00436-009-1499-5.
Böhm C, Wolken S, Schnyder M, Basso W, Deplazes P, Di Cesare A, Deuster K, Schaper R. Efficacy of emodepside/praziquantel spot-on (Profender®) against adult Aelurostrongylus abstrusus nematodes in experimentally infected cats. Parasitol Res 2015;114:S155-64. doi: 10.1007/s00436-015-4521-0.
Hawley MM, Johnson LR, Traversa D, Bucy D, Vernau KM, Vernau W. Respiratory distress associated with lungworm infection in a kitten. J Feline Med Surgery. 2016;2(2):1–6. doi: 10.1177/2055116916675801.
Cavalera MA, Colella V, Napoli E, Arfuso F, Panarese R, Brianti E, Otranto D. Shedding of feline lungworm larvae and their infectivity to snail intermedia te hosts after anthelmintic treatment. Int J Parasitol. 2019;49(6):449–53. doi: 10.1016/j.ijpara.2018.12.008.
Gambino J, Hiebert E, Johnson M, Williams M. Diagnosis of Aelurostrongylus abstrusus verminous pneumonia via sonography-guided fine-needle pulmonary parenchymal aspiration in a cat. J Feline Med Surg. 2016;2(1):1–6. doi: 10.1177/2055116916646584.